研究題目
- 「胚誘導現象における、細胞外シグナルと細胞内因子の転写因子を介した統合メカニズム」
現在までの研究と成果
- 大学院修士課程までは、無性生殖を行うミサキマメイタボヤの囲鰓腔上皮細胞を用いた研究を行い、出芽および再生過程における分化多能性の制御のしくみを解析した。まず、囲鰓腔上皮細胞由来の培養細胞に対して細胞増殖抑制および凝集活性を持つ因子を精製した。このような活性はこの囲鰓腔上皮培養細胞が脱分化しさらに種々の組織へと再分化するのを抑え、囲鰓腔上皮の分化状態の維持に関与している。この因子を、最終的に2つのペプチドを含む画分にまで精製し、アミノ酸配列を断片的にシークエンスして、その配列をもとに全長cDNAをクローニングした。2つのペプチドはC型レクチン(TC14-1)と類似性が高く、片方は以前にcDNA断片が報告されていたレクチン(TC14-2)であり、片方は新規レクチンであった(TC14-3と命名)。次に、大腸菌を用いて、TC14-2,3のリコンビナントタンパク質をつくり、糖鎖結合能を調べた。すると、これらのレクチンはカルシウム依存的にガラクトースに結合した。しかし、培養細胞に対しては3種類のうちTC14-3のみが細胞増殖抑制および凝集活性を持っていた。また、確かにTC14-3は囲鰓腔上皮への分化を誘導し、維持する作用を持っていることが確認された。培養細胞に対するTC14-3の活性はガラクトースの添加で完全に失われたので、ガラクトース結合能がこれらの活性に必要であることがわかった。過去の知見なども含めて考えると、TC14-3は形態形成領域に囲鰓腔上皮細胞を供給し、形態形成を手助けしていることが示唆された(Development,
2001)。
博士課程から現在までは、マボヤとユウレイボヤを用いて、単純な神経系を持つホヤ幼生の神経発生における転写調節メカニズムを研究した。マボヤ-シナプトタグミン(Hr-syt)は、シナプス伝達に関わる分子で、幼生期からすべてのニューロンで発現する。その発現はHr-sytの5’上流3.4kbpのプロモーター領域で制御されることがわかっていた。そこで、デリーションコンストラクトによるレポーターの発現解析を行い以下のことを明らかにした。
ニューロンでの発現に関わる領域は複数存在した(Dev.
Biol.,
2002)。それらのうちの3つを200bp以下の領域に絞り込んだ。1つ目は-558から-477の領域で、この領域を欠くと異所的なレポーター発現がみられる事から、異所的発現を抑制することで発現をニューロンに限定するための領域である事が示唆された。2つ目は-2900から-2700の領域で、この領域を欠くとプロモーター活性が弱くなり、タンデムに2つ並べるとプロモーター活性が強くなったことから、ステップアップファクター結合サイトであると予想された。3つ目は5’UTR上の+100から+200の領域で、この領域を欠くとニューロンでの発現がなくなった。この領域にはE-box2つを含む特徴的な配列が並んでいることから、そこにhelix-loop-helixタイプの転写因子が作用し、ニューロンでの発現を活性化していることが予想された。現在、この領域に作用する転写因子を調べている。
マボヤsytプロモーターをユウレイボヤに導入したところ、ニューロン特異的な発現が誘導された。逆に、ユウレイボヤsytプロモーターもマボヤとユウレイボヤの両種においてニューロンでの発現を引き起こした。この事から、2種間に共通のニューロン特異的な発現制御領域が存在する事が予想された。しかし、単純なプロモーター配列比較では類似配列を見出す事はできず、現在、両種で共通に働くニューロン特異的な発現制御領域を探査中である。ちなみに、マボヤで同定したニューロン特異的な発現制御領域(-558から-477および-2900から-2700)はユウレイボヤでも働く事がわかった。
研究目的
-
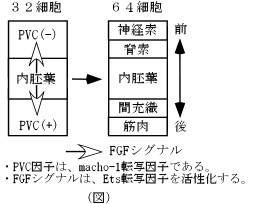
私は、生命が1つの卵から親個体まで形づくられる仕組みに興味を持っており、それを解明していくことで人類にとって有益な知的財産が得られると考えている。近年、脊索動物のホヤを用いた研究が世界中で注目されてきており、ゲノム解析やEST解析なども行われ実験動物としての価値が高まっている。また、ホヤはシンプルで実験が組みやすい。実際、西田らによってホヤ胚発生過程における中胚葉のパターニングが明らかにされつつあり、そのモデルは非常にシンプルなものである(図)。卵細胞質内で後方に位置するマイオプラズム(PVC因子)の存在下では間充織や筋肉などの後方組織、PVC因子非存在下では脊索、神経索などの前方組織が作られる。一方で32細胞期から64細胞期の間に内胚葉からのFGFシグナルによる誘導を受けると脊索や間充織が誘導され、逆にFGFシグナルの誘導を受けないと細胞はデフォルトの運命である神経索や筋肉に分化する。さらに、PVC因子の実体はジンクフィンガードメインを持ち筋肉のデターミナントして同定されたmacho-1である。すなわち、macho-1を持った細胞がFGFシグナルを受け取ると間充織が誘導され、持たない細胞がシグナルを受け取ると脊索が誘導される。誘導を媒介するFGFシグナリング経路においては、他の多くの生物同様にFGFR、Ras、Raf、MEK、MAPK、Etsのリン酸化カスケードが保存されている。しかし、これらの因子がどのように分子的に相互作用して以降の遺伝子発現ひいては中胚葉のパターンニングに関わっているかは現在わかっていない。本研究では、これらの事をふまえてFGFシグナルの下流因子Etsの転写調節機構を中心にして、ホヤ胚における中胚葉のパターニング機構を更に深く解析する。特に、macho-1とEtsとがどのような仕組みで協調的に働き細胞の運命決定を調節しているのか解析したい。
研究内容
- 胚誘導には細胞外から来るシグナルと細胞内の因子が関係している。この二つの要素が、誘導が起こる細胞内で統合されることにより、細胞の運命などが決定される。細胞内の因子は、誘導シグナルが来たときの応答細胞の応答能もしくは反応能の制御に関わっている。ここで解析しようとしている系では、細胞外シグナルはFGFであり、最終的にEts転写因子の活性化を引き起こす。反応能を決めている細胞内転写因子はmacho-1である。この二つの転写因子が働く組み合わせにより、4種類の組織(神経索・脊索・間充織・筋肉)がホヤ胚の赤道領域に形成される。しかし、どの様な分子機構で、内在因子(macho-1)とシグナル伝達系(Ets)の情報が細胞内で統合されるかは不明である。この系はすでにキー分子がわかっているので、誘導現象を解析する上でモデルケースとなりうる。実際にはいろいろなケースを想定しつつ、解析を以下のように行っていく。
Etsにはいろいろな因子が協調的に働いているという報告がある。そこで、Etsとmacho-1が直接結合して作用しているかを、それぞれのリコンビナントタンパク質を大腸菌に作らせて調べる。手法としてはプルダウンアッセイ法もしくは抗体沈降法を用いる。また、Etsに結合しうる他の因子についての探査も行う。
次に、Etsタンパク質の局在を調べるために、Etsタンパク質を特異的に認識する抗体の作成を行う。作成に使う抗原はリコンビナントEtsタンパク質を用いる。できればリン酸化したEtsとリン酸化していないEtsを認識する抗体をそれぞれ作成できればFGFシグナル経路の働く過程を可視化することができるだろう。
現在までの知見では、FGFシグナリングに依存して脊索細胞ではBrachyuryの遺伝子発現が64細胞期に活性化される。これに対し、間充織細胞では、64細胞期に筋肉アクチンの遺伝子発現がいきなり抑制される。この二つの現象にはEts転写因子が必要である。そこで、Etsが下流遺伝子をどのように制御するかを調べるために、Etsと転写活性化ドメイン(VP16)もしくは抑制化ドメイン(EnR)とを融合させたmRNAを作り、ホヤ卵に顕微注入して調べる。この方法がホヤでもうまくいくことはmacho-1のケースで確かめられている。この実験を行い、下流遺伝子のBrachyuryとactinの発現を調べると、Etsが転写活性化因子なのか、それとも抑制化因子なのか、はたまた下流遺伝子に依存してどちらにもなれるかを確実に判定できる。
Etsとmacho-1は直接には結合しないかもしれない。その場合は、これらの情報の統合は、下流遺伝子の発現制御領域上で行われると考えられる。私は以前の研究で、プロモーター解析をおこなってきた。この経験を生かして、Etsもしくはmacho-1のすぐ下流で影響を受ける遺伝子のプロモーター解析を行う事によって、下流遺伝子の転写調節機構を詳細に調べたい。Etsとmacho-1の影響を直接受けていると予想される遺伝子のプロモーターを複数クローニングして転写調節領域を解析する。誘導の結果、予定脊索割球で発現する遺伝子としては、Brachyuryがある。間充織でmacho-1により活性化されEtsにより再び抑制される遺伝子としてはアクチン、ミオシン、Caトランスポーター、Tbx-6などがある。これらの遺伝子近傍でEts
結合配列を検索するとともに、ホヤ卵へ遺伝子導入し、Etsとmacho-1応答配列をレポーターアッセイによりスクリーニングする。その後Etsとmacho-1の結合する配列をゲルシフトにより特定する。
このようにEtsとmacho-1の両転写因子がどのように協調的に働くかについて解析するとともに、誘導現象における細胞内因子および細胞外シグナルの統合に関して洞察を行う。
年次計画
- 1年目
・Etsとmacho-1蛋白質の直接の相互作用について調べる。大腸菌発現ベクターにEtsとmacho-1を組み込み、大腸菌に発現させ精製する。作成したリコンビナントタンパク質を用いてプルダウンアッセイ法を用いた結合実験を行う。必要であればEtsタンパク質をキナーゼでリン酸化し、それも用いてみる。
・抗体によるタンパク質の発現場所と活性化場所の特定。Ets、リン酸化Ets、macho-1のリコンビナントタンパク質を用いて、抗体の作成を行う。作成した抗体を用いていろいろな発生ステージにおけるタンパクの発現場所を特定する。
2年目
・ホヤのEtsが転写抑制型か活性化型か、またはその両方の転写因子として働くのかを調べる。Etsと転写活性化ドメインVP16もしくは抑制化ドメインEnRを融合させたmRNAを作成し、ホヤ胚に顕微注入する。形態や分化マーカーで細胞の分化状態をチェックする。
・下流遺伝子の発現制御領域のクローニング。Ets、macho-1の下流で働く複数の遺伝子のプロモーターをゲノムからクローニングする。配列の解析を行った後、これらのプロモーターをルシフェラーゼレポーターのベクターに組み込む。
3年目
・Ets、macho-1がターゲット遺伝子の転写をプロモーター上でどのように制御するかを調べる。FGF処理、もしくはEts、macho-1の異所的発現に応答するプロモーターをスクリーニングする。これらのプロモーターのデレーションコンストラクトを作成し、Etsおよびmacho-1に応答する配列を限定していく。Etsもしくはmacho-1が結合する配列をゲルシフトアッセイにより決定する。
この研究の特色と独創的な点
- 動物の発生では、様々な誘導作用が重要な働きをしていることが知られている。しかし、近年の知見によると、細胞間シグナルとして働ける分子の種類が限られており、動物は同じシグナル分子を様々な時間的・空間的局面で使い回ししていることが示されている。すなわち、同じシグナルを受け取ったとしても、細胞はそれぞれの状況に応じて異なる応答を示す。このことは、細胞の応答能の制御がこれからの誘導現象の解析においてますます重要視されるであろうことを予測させる。この研究では、誘導現象において、細胞外から細胞内に伝えられるシグナルからの情報と、細胞内にあって細胞の応答能を支配している因子からの情報が、いかに細胞内で統合されるかを明らかにすることを目的としている。ここで解析しようとしている系では、細胞外シグナルはFGFであり、最終的にEts転写因子の活性化をもたらす。反応能を決めている細胞内因子はmacho-1転写因子であることがわかっている。この系は、そのシンプルさと、すでにキーとなる分子がわかっているということにおいて多大な利点を持っており、誘導現象の概念形成上重要な貢献をもたらすことが期待される。
本研究では、脊索動物であるホヤの胚というシンプルなシステムを解析対象としている。10月から5月にかけてのシーズン中は、毎日産卵させ受精させることができるので、非常に早いサイクルで実験が行える。また、受精から誘導が起こる時期までは6時間である。そして、細胞系譜が詳細にわかっており、割球1つ1つの発生運命の解析が可能である。胚操作が行えるため、細胞の分化を人為的に操作しながら、ひとつひとつの細胞レベルで解析を行うことができるのは、他では類を見ない特徴である。特に所属希望先の西田研究室は、この種の実験技術に熟達しており、詳細な解析方法と、クリアーな実験結果を得るための方法論に秀でていると思っている。誘導現象に関わる分子的な機構を解析するのにも、これらのホヤ胚の特徴は大きく貢献するだろう。
また、これまでの解析によりすでにキーとなる分子が判明しているということも、今回のテーマに関する解析を行うにあたり、大きな利点であろう。研究を始めるに当たり、準備が十分に整っているということを意味している。おそらく、本研究によりテーマに沿った有用な結果が得られる可能性はかなり高いと思われる。研究対象にしている2つの転写因子は興味深い特徴を持っている。FGFシグナルは、さまざまな組織への誘導能を持っていることが知られており、ホヤにおいては神経細胞や脊索組織、間充織組織への誘導能を持つ。どの細胞タイプが誘導されるかはシグナルを受け取る側の細胞に依存している。FGFにより活性化されるEtsはホヤのみならず、様々な細胞間相互作用で使われていることがわかっている。一方、もう1つの因子macho-1は局在性を示す母性遺伝子である。macho-1は、細胞の応答能をコントロールしており、特異的な分子であり、一般的なEtsシグナルに対する細胞の応答を特異化している。細胞外と細胞内の情報は、このように転写因子を通して統合されることがわかっているが、現在の所その後に何が起こるかがブラックボックスとなっている。
この研究では、両転写因子の直接の相互作用の可能性、もしくは、下流遺伝子の発現をその制御領域を通して互いに独立に制御している可能性の両方について検討し、誘導現象の一般的な理解につながることを期待して、研究を計画した。このように、1.あまり解析されてこなかったがこれから重要になるであろう、細胞外シグナルと細胞内因子の情報の統合を解析すること、また、2.ホヤというシンプルでかつ多くの利点を持った系を用いること、3.このテーマに沿った実験を行うために機が熟していることなどを、この研究の特色・独創的な点として挙げることができる。
学術雑誌等で発表した論文
- 松本潤(筑波大学医学研究科博士課程)、中本千晶(高知大理学研究科大学院)、藤原滋樹(高知大理学部助教授)、指吸俊次(高知大理学部教授)、川村和夫(高知大理学部教授)
A
novel C-type lectin regulating cell growth, cell adhesion and cell
differentiation of the multipotent epithelium in budding
tunicates
Development 2001 Sep; 128(17): 3339-47
- 勝山裕1(ポスドク)、松本潤(筑波大学医学研究科博士課程)1、
岡田俊昭(ポスドク)、大塚幸雄(産総研研究員)、陳玲(ポスドク)、岡戸晴生(東京都神経研主任研究員)、岡村康司(産総研主任研究員、岡崎国立研究所教授併任)
1Y.K.
and J.M. contributed equally to this work
Regulation of Synaptotagmin Gene Expression
during Ascidian Embryogenesis
Developmental Biology 2002 April;
244,293-304
学会等で発表した論文
- 大森省吾、松本潤、藤原滋樹、川村和夫、指吸俊次
ミサキマメイタボヤの分化多能性幹細胞の凝集に関与するレクチンの発現と機能の解析
日本動物学会第67回大会、札幌、1996年9月18日ー20日
松本潤、大森省吾、藤原滋樹、川村和夫、指吸俊次
ミサキマメイタボヤから単離された新規レクチンの構造および機能解析
日本動物学会第68回大会、奈良、1997年10月2日ー4日
- 松本潤、大森省吾、藤原滋樹、川村和夫、指吸俊次
ミサキマメイタボヤレクチンTC-30の構造と機能解析
第31回日本発生生物学会、熊本、1998年5月29日
- 松本潤、藤原滋樹、川村和夫、指吸俊次
出芽ホヤレクチンによる上皮性細胞への分化誘導
第32回日本発生生物学会、神戸、1999年5月28ー30日
- 松本潤、勝山裕、岡村康司
ホヤシナプトタグミン遺伝子におけるニューロン特異的な発現に関わるシスエレメントの解析
第33回日本発生生物学会、高知、2000年5月25ー27日
- Jun Matsumoto, You Katsuyama and Yasushi Okamura
Multiple cis-regulatory regions control neuronal gene expression
of synaptotagmin in ascidian embryos
The First International
Symposium on the Biology of Ascidians(Sapporo, Japan) June
26-30,2000
この学会の内容は以下のプロシーディングで発表
J. Matsumoto, Y. Katsuyama, Y.
Ohtsuka and Y. Okamura
The Biology of Ascidian (Springer):
158-161
Multiple cis-regulatory regions control neuronal gene
expression of synaptotagmin in ascidian embryos
- J. Matsumoto, Y. Katsuyama, Y. Ohtsuka and Y. Okamura
Multiple cis-regulatory regions control neuronal gene expression
of synaptotagmin in ascidian embryos
14th international congress of
developmental biology (Kyoto, Japan) July 8-12,2001
- 松本潤、岡村康司
2種のホヤを用いたシナプトタグミン遺伝子のプロモーター解析
第35回日本発生生物学会、横浜、2002年5月21−23日
もっとも主要な論文の要旨
- Development 128, 3339-3347 (2001)
A novel C-type
lectin regulating cell growth, cell adhesion and cell differentiation of the
multipotent epithelium in budding
tunicates
(ミサキマメイタボヤにおける分化多能性上皮細胞の細胞増殖、細胞接着、細胞分化を調節する新規C型レクチン)
J.
Matsumoto, C. Nakamoto, S. Fujiwara, T. Yubisui, and K.
Kawamura
無性生殖や再生の過程において、個体の組織や器官の再構築には、未分化な幹細胞の増殖と分化が必要である。原索動物のミサキマメイタボヤは出芽という無性生殖により、新たな個体を形成する。この系において、幹細胞の役割を担うのが囲鰓腔上皮と呼ばれる分化多能性を持つ細胞である。出芽過程においては、この細胞がいったん脱分化することにより、消化管や鰓などの器官再分化して形態形成が行われると考えられている。また、この分化多能性の上皮細胞を培養すると、囲鰓腔上皮としての分化状態を失い、増殖を続けることがわかっている。その性質を利用して囲鰓腔上皮ホヤの培養細胞株が川村らによって確立され、継代培養されている。このホヤ培養細胞に対して、細胞凝集や細胞増殖抑制作用を持つ生理活性因子がミサキマメイタボヤ自体のホモジネート抽出液中に発見された。
この論文ではこの生理活性因子の同定および解析を行っており、私は以下の実験を担当した。まず、ミサキマメイタボヤホモジネートから、ホヤ培養細胞に対する細胞凝集活性を指標にして、この生理活性因子の精製を進めた。ゲルろ過クロマトグラフィー、陰イオン交換クロマトグラフィー、ゲルろ過HPLCと精製を進めたところ、18kDaと15kDaのペプチドが単離された。この2つのポリペプチド(P18/P15)はSDS-PAGE上でほぼ1:1の量比で存在しており、クロマトグラフィーとゲルろ過HPLCでは各々を分離することはできなかった。そこで、P18/P15のアミノ酸配列を部分的にシークエンスした。するとBlastサーチにより、以前にミサキマメイタボヤで見つかったガラクトース結合C型レクチンTC14-1(tunicate
C-type lectin
TC14-1)に高い類似性があることがわかった。次に、P18/P15の糖結合能をガラクトース固定化アフィニティーカラムで調べた。P18/P15はカルシウム存在下でガラクトース固定化アフィニティーカラムに結合し、カルシウムをEDTAでキレートすることで溶出してきた。そして、溶出したP18/P15はホヤ培養細胞に対する細胞凝集活性を持っていた。つまり、P18/P15はホヤ培養細胞に対する細胞凝集活性を持つレクチンであることが確定した。次に、部分アミノ酸配列をもとに全長cDNAをクローニングした。P18は以前にcDNA断片が報告されていたTC14-2と完全に一致していた。そして、P15は新規に見つかったのでTC14-3と名づけた。これら3つのレクチンの予想アミノ酸配列はともに145残基で、C型レクチンに特徴的な8アミノ酸が保存されており、N末端には20残基のシグナルペプチドと考えられる配列があった。予想アミノ酸配列を比較すると、TC14-1とTC14-2は84.8%、TC14-1とTC14-3は65.7%、
TC14-2とTC14-3は65.0%の類似性を示した。
生体から精製したTC14-2/TC14-3(P18/15)はカラム精製で互いに分離する事ができなかった。そこで、各々のcDNAを大腸菌発現ベクターに組み込みリコンビナントタンパク質(rTC14-2、rTC14-3)を作製した。rTC14-2とrTC14-3は、それぞれ単独でカルシウム依存的にガラクトースに結合した。だが、ホヤ培養細胞に対してはrTC14-3のみが細胞凝集活性を示し、TC14-1とrTC14-2は細胞凝集活性を示さなかった。次に、rTC14-3の持つガラクトース結合能がホヤ培養細胞に対する細胞凝集活性に必要なのか調べた。フリーのガラクトースをTC14-3と共に細胞培養液に添加して、TC14-3のガラクトース結合ドメインをブロックした。すると、50mMのガラクトース添加でTC14-3の細胞凝集活性は完全に阻害された。この結果から、TC14-3のガラクトース結合能は、ホヤ培養細胞に対する細胞凝集活性に必須である事が示された。なぜTC14-3のみがホヤ培養細胞に対する細胞凝集活性能を持つのかは不明である。その理由の1つとして考えられるのは、TCレクチンの認識する細胞表面の糖鎖の違いである。一般的に細胞表面はガラクトースのような単糖ではなく多糖になっており、その立体構造は細胞表面の情報として利用されている。今回実験に用いた囲鰓腔上皮由来のホヤ培養細胞表面の糖鎖情報はTC14-3のみが認識可能であり、その結果として細胞凝集活性を示したと推察された。
囲鰓腔上皮由来のホヤ培養細胞は、継代培養下では脱分化していると考えられており、囲鰓腔上皮としての分化状態を示さない。そこで、このような性質の細胞株にTCレクチンを作用させた時の分化状態を調べた。分化の指標として、囲鰓腔上皮もしくは消化管に対する特異的抗体(それぞれAP-EとAP-G)を用いて抗体染色を行った。TC14-1とrTC14-2を作用させた細胞はどちらの抗体にも反応しなかった。しかし、rTC14-3を作用させた細胞は、AP-Gには反応しなかったが、AP-Eにはすべての細胞が強く反応した。つまり、TC14-3の作用により、ホヤ培養細胞はもとの囲鰓腔上皮の分化状態に誘導されたと考えられる。
以後、川村らによって以下の実験が補足された。TC14-3の作用によるホヤ培養細胞の細胞数の変化を調べたところ、細胞増殖が抑制されることがわかった。また、TC14-3の作用により細胞接着に関わるαインテグリンが培養細胞表面に誘導されることがわかった。αインテグリンはミサキマメイタボヤ生体内では囲鰓腔上皮細胞で発現しているので、TC14-3の作用によって細胞接着が誘導され、培養細胞は上皮細胞の形態になっている事が示唆された。TC14-3のモノクローナル抗体を作成しタンパクの発現場所を調べたところ、親個体では囲鰓腔上皮と血球細胞で発現がみられた。これにより、間充織内の流動的な血球細胞のうち、特定の細胞がTC14-3の作用を受け、囲鰓腔上皮として分化することが示唆された。また、出芽中の芽体ではTC14-3が特に強く発現しており、囲鰓腔上皮細胞の供給を盛んに行っていると考えられた。また、囲鰓腔上皮が脱分化する芽体後方の形態形成領域ではTC14-3の発現は消失していた。よって、形態形成のシグナルを受けた領域でTC14-3が消失することが、囲鰓腔上皮の脱分化に必要だと考えられた。
以上、この論文では、新規にガラクトース結合C型レクチンTC14-3をクローニングし、レクチンによる細胞の分化制御について新たな報告を行った。